pollution pourquoi 30.000 morts en 2003 et 6000 morts en 2015
Beethoven Ode à la joie au violon
La recommandation 1432 du conseil de l’Europe a mis deja l'accent sur ce probleme oublie par nos gouvernements successifs
C'est un acte volontaire de complicité de crime contre l’humanité comme en 2003 ou 2015
La pollution photochimique (ou pollution photo-oxydante) est un ensemble de phénomènes complexes conduisant à la formation d'ozone (O3) et d'autres composés oxydants (tels que peroxyde d'hydrogène, aldéhydes, peroxy acétyl nitrate (PAN)) à partir de polluants primaires (appelés précurseurs) : oxydes d'azote (NOx), composés organiques volatils non méthaniques (COVNM), monoxyde de carbone (CO) et méthane (CH4), et d'énergie apportée par le rayonnement ultra-violet (UV) solaire. Cette pollution atmosphérique riche en ozone, appelée aussi « smog », se rencontre dans la basse couche de l'atmosphère, ou troposphère (0 à 8-10 km d'altitude). La durée de vie de l'ozone est estimée à environ 22 jours mais cette durée de vie est plus courte au niveau de la couche de mélange (0 à 2 km), soit seulement de 1 à 2 jours.
L'ozone et les oxydants photochimiques sont des polluants secondaires.
Les réactions chimiques mises en jeu sont complexes mais peuvent être représentées de façon simplifiée. Elles mettent en jeu en atmosphère polluée, le NO2 et des COVNM, polluants primaires ou précurseurs.
NO2 est dissocié sous l'action du rayonnement UV :
NO2 + h ν→ NO + O [a] à des longueurs d'ondes λ < 430 nm
L'oxygène atomique ainsi créé réagit avec l'oxygène moléculaire pour former l'ozone qui est une molécule constituée de 3 atomes d'oxygène :
O + O2 → O3 [b]
L'ozone réagit avec le monoxyde d'azote pour redonner NO2 :
O3 + NO → NO2 + O2 [c]
Le NO est qualifié de « puits d'ozone » puisqu'il contribue à limiter la concentration d'ozone en le consommant.
Les concentrations d'ozone dépendent du rapport entre concentrations de NO2 et concentrations de NO.
Sans présence de COV, et de l'acide nitreux l'ozone est peu abondant.
Composé chimique dont la formule est HNO2. Provient de la réduction du dioxyde d'azote NO2. Dégradée en radicaux libres (OH-) par la lumière, cette molécule intervient dans la fabrication de l'ozone troposphérique. Les OH- s'associant aux composés organiques volatiles et formant l'ozone O3.
Les émissions naturelles biogéniques d’oxyde d’azote (NO) par les sols jouent un rôle important dans l’augmentation des teneurs atmosphériques en composés azotés réactifs, NO étant lui-même un composé réactif qui en forme d’autres par oxydation. Elles participent en outre à la formation d’ozone dans la basse atmosphère.
Ces émissions biogéniques de NO représentent environ 20 % des émissions totales de NO depuis la surface (le reste étant d’origine humaine). Elles sont dues à la nitrification, un processus d’oxydation de l’ammonium (NH4+) en nitrites (NO2-) puis en nitrates (NO3-) par certaines bactéries du sol. Elles varient donc en fonction de l’activité microbienne du sol mais aussi de ses propriétés physicochimiques (température, contenu en eau, acidité et quantité intrinsèque d’azote).
les oxydes d'azote (NO et NO2 surtout), produits par les éclairs et différents processus bactériens, se dissolvent dans l'eau pour former des solutions diluées d'acide nitreux (HNO2) et d'acide nitrique (HNO3). Les précipitations acides peuvent nuire à l'environnement. Dans plusieurs régions de l'Europe dont la FRANCE , les précipitations présentent un pH annuel moyen se situant entre 4,0 et 4,5, environ 40 fois plus acide que les précipitations normales. Lorsque le pH des ruisseaux, des lacs et des autres cours d'eau tombe sous 4,5, la plupart des espèces vivantes comme les poissons, les grenouilles, les escargots et la végétation aquatique meurent. Par contre, certains types d'algues (qui préfèrent les conditions acides), prolifèrent dans ces eaux acides Algues vertes et bleues . Les précipitations acides endommagent les forêts en réagissant avec les oxydes d'aluminium, de plomb et de cadmium pour produire des ions métalliques libres, et avec le mercure pour former des composés organiques. Les ions métalliques sont assimilés par les racines des plantes et peuvent être dommageables ou mortels pour certains végétaux.
L’acide nitreux (HONO) est également un précurseur de composés azotés réactifs, émis par les sols dans des conditions de température et d’humidité similaires à celles de NO, mais il a été nettement moins étudié et quantifié.
En présence de COV, un ensemble complexe de réactions se met en route et conduit à l'accumulation d'ozone. Ces réactions enrichissent le réservoir atmosphérique en NO2 en consommant du NO [selon la réaction f décrite ci-dessous] qui ne peut plus jouer son rôle de puits d'ozone [réaction c]. Il y a production de NO2 sans destruction d'ozone. La décomposition des COV est déclenchée par le radical OH (radical hydroxyle) qui est très réactif et présent de façon naturelle dans l'atmosphère avec l'acide nitreux
RH + OH → R + H2O [d] (RH est une représentation simplifiée d'un COV, R représentant une molécule organique associée à l'hydrogène)
R + O2 → RO2 [e]
RO2 + NO → NO2 + RO [f]
Ces réactions génèrent de nombreuses espèces organiques gazeuses et notamment des composés organiques nitrés tel que le péroxyacétylnitrate (PAN).
La figure suivante présente les processus chimiques clefs conduisant à l'ozone. La quantité d'ozone présente dans la troposphère est estimée à 4 500 Tg/an (un Teragramme (Tg) est équivalent à 1 million de tonnes). Les entrées venant de la stratosphère sont estimées à 540 Tg/an. L'ozone est détruit par voie chimique et par les dépôts secs.
Figure 1 : Processus chimiques clefs conduisant à la formation d'ozone et budgets d'ozone dans la troposphère
Source [RSS, 2008]
Les conditions météorologiques favorisant l'apparition de fortes concentrations d'ozone sont notamment :
-
une température élevée de l'air,
-
une faible teneur en humidité de l'air,
-
une longue durée d'ensoleillement,
-
une forte irradiation,
-
une faible vitesse synoptique du vent (vents à grande échelle par opposition aux vents locaux).
La pollution photochimique est un phénomène caractéristique des situations estivales anticycloniques.
Une des caractéristiques importantes de la chimie atmosphérique est son caractère non linéaire. Cela signifie que la production d'ozone n'est pas proportionnelle aux teneurs en précurseurs. Selon l'abondance relative des divers composés, ce sont les réactions de formation ou de destruction qui sont favorisées.
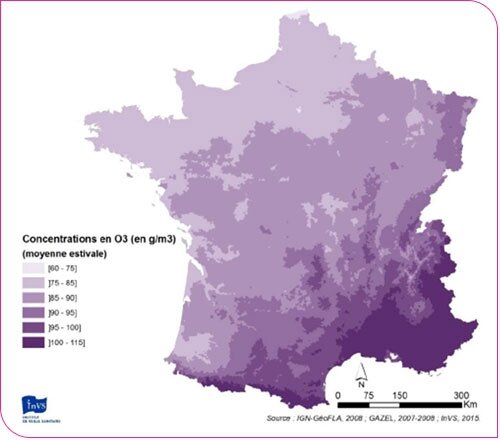
C'est ce qui explique que, de façon surprenante, les concentrations d'ozone mesurées loin des sources des précurseurs (une agglomération par exemple) sont plus élevées que celles mesurées près des sources émettrices elles-mêmes. Ainsi, les zones suburbaines et rurales sont plus touchées que les zones urbaines par les phénomènes de pointes de concentrations en ozone. En effet, sur une ville par exemple, les émissions de NO (liées au trafic notamment) sont élevées. L'ozone susceptible de se former est rapidement détruit par le NO présent en forte concentration. Si le nuage de polluants formé sur la ville se déplace à la campagne, où les émissions de NO sont moindres, les concentrations d'ozone augmentent puisque l'ozone n'est plus consommé.
L'ozone troposphérique est impliqué dans l'effet de serre. Il est le troisième 3e gaz à effet de serre en terme de PRG après le CO2 et le CH4 selon le 4e rapport d'évaluation du GIEC [GIEC, 2007]. Son forçage radiatif est de 0,35 W.m2 [GIEC, 2007]. Ce gaz n'est pas encore pris en compte dans les engagements de réduction des gaz à effet de serre mis en place au niveau international dans le cadre de la Convention Cadre des Nations Unies sur les Changements Climatiques (CCNUCC). Or, pour les scientifiques, l'augmentation des concentrations de fond milite pour des actions de réduction au niveau global. L'augmentation des températures liées au changement climatique favorisent les réactions conduisant à l'ozone troposphérique. En raison de l'impact de l'ozone sur la végétation (voir ci-après) et donc sur le puits de carbone, l'augmentation de ses concentrations dans la troposphère, pourrait conduire à une amplification de l'effet de serre. Les scientifiques recommandent donc de ne plus se satisfaire des actions régionales de réduction des émissions des précurseurs mais de mettre en place des actions au niveau global et d'agir sur les émissions de CH4 et de CO [UNECE, 2010].
L'heure d’été étant un facteur aggravant doit etre abandonne rapidement afin de purifier l'air rapidement sans une dépense accrue pour mettre en place une solution efficace...Impacts de l'ozone sur la santé humaine et les végétaux
L'ozone troposphérique a un impact sur la santé humaine. Il entraîne une irritation des voies respiratoires et des yeux, une baisse des performances physiques et une détérioration de la fonction pulmonaire. En Europe, le nombre de décès prématurés dus à l'ozone est estimé à 22 700 cas en 2000. 30 000 morts en 2003 en France et 6000 morts en 2015 . Le scénario Baseline déterminé par l'International Institute for Applied Systems Analysis (IIASA) dans le cadre des travaux de révision du Protocole de Göteborg (prenant en compte la législation européenne visant à limiter les émissions de gaz à effet de serre (GES) et la mise en œuvre intégrale de l'ensemble des directives européennes limitant les émissions de polluants (voir ci après)) permettrait de limiter ce nombre à 17 400 en 2020 [AMANN, 2011].
L'ozone perturbe l'activité photosynthétique des plantes et altère leur résistance. L'ozone attaque les plantes par leurs stomates. Les plantes absorbent moins d'ozone par temps sec que par temps humide. En effet, les stomates se referment par temps sec pour protéger la plante de la sècheresse et la protège de ce fait de l'ozone. Les plantes sont plus ou moins sensibles à l'ozone. Ce dernier provoque des dégâts visibles sur le feuillage (jaunissement par exemple) et entraîne des déficits en croissance. Des études montrent que la productivité des cultures diminue avec la présence d'ozone. La figure 4 suivante présente les pertes de rendement de blé en 2000 et 2020 selon un scénario où les émissions des précurseurs sont cependant réduites selon les travaux des groupes d'experts des effets (Working groups on effects (WGE) travaillant sous l'égide des Nations Unies dans le cadre de la Convention sur la Pollution Atmosphérique Transfrontière à Longue Distance














/http%3A%2F%2Fstorage.canalblog.com%2F14%2F19%2F1390704%2F127848585_o.png)
/http%3A%2F%2Fstorage.canalblog.com%2F20%2F87%2F1390704%2F116414786_o.jpg)
/http%3A%2F%2Fstorage.canalblog.com%2F56%2F10%2F1390704%2F120116339_o.jpg)
/http%3A%2F%2Fstorage.canalblog.com%2F63%2F42%2F1390704%2F114681562_o.jpg)