Pesticide l'information cachée médiatique du Ministère de l’environnement
20180314_M_Labrousse_1413192__1_
Pesticide l'information cachée médiatique du Ministère de l’environnement
A l'occasion de travaux, dont un extrait est paru dans l'édition courante du journal Nature, des chercheurs européens ont mis en évidence une nouvelle source de production de l'acide nitreux, ce composé qui interagit avec la lumière pour produire des radicaux hydroxyle et participe ainsi à la production d'ozone dans les couches basses de l'atmosphère.
Le fait d'avancer les activités humaines vis a vis du soleil a aggraver les deux gaz a effet de serre Ozone et dioxyde d'azote sans les transports
Le fait de supprimer les transports cette pollution ne diminue guerre
Les massifs montagneux sont l'exemple a na pas suivre et ni a respirer le mauvais air a partir de la fin Mars jusqu'au mois d'octobre
Les seuils a la santé sont explosé sans ne prise de conscience administrative qui veut nier les faits
Les assignations récurrente de la FRANCE devant la Commission européenne sont un principe de précaution a tenir en compte
Nos gouvernements et nos institutions vocifèrent les transports,les transports et les transports mais ne veulent pas et ne désir pas a tenir compte de la recommandation 1432 du Conseil de l’Europe
Les amis du maréchal Pétain de l'ADEME sont responsables et maquillent tous les rapports a leur convenance et avec le Ministre de l’écologie qui n'ont jamais rien compris au fonctionnement de la pollutions
Les ministres ont toujours cru que la pollution est une émanation alors que cette dernière est une retombée
Nous avons eu les ministres que nous méritions par leur incompétence. Ils ont été des éoliens de l'inertie en brassant de l'effet médiatique....
Alors qu'on supposait que l'acide nitreux (HNO2) ne se formait qu'à la faveur de la nuit, des mesures fines menées par l'université de Wuppertal, en Allemagne, ont révélé l'existence d'une surproduction diurne de ce composé, et des concentrations nettement supérieures aux prédictions.
Des chercheurs du Laboratoire d'application de la Chimie à l'Environnement de Villeurbanne, en collaboration avec l'université de Wuppertal et l'Institut Paul Scherrer, en Suisse, sont parvenus à déterminer l'origine de cette surproduction. Ils publient leurs résultats dans l'édition du 9 mars du journal Nature, et révèlent que la photoréduction du dioxyde d'azote (à l'origine de la production d'acide nitreux) est facilitée par l'absorption du rayonnement lumineux par les substances humiques - des composés obtenus par décomposition de la matière organique biogène - présentes à la surface de la Terre.
Ces substances humiques se trouvant en fortes quantités dans les zones rurales, mais également dans les villes, la surproduction diurne d'acide nitreux qu'engendre ce phénomène est non négligeable : en effet, selon les chercheurs, il serait responsable de la moitié des radicaux hydroxyles produits dans les milieux citadins..
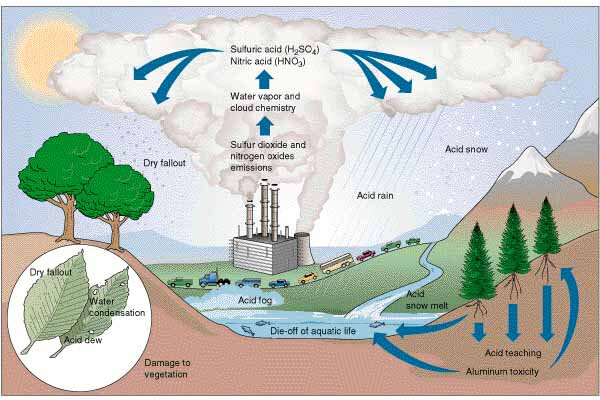
L’ozone L’ozone est un polluant qui a des effets néfastes sur la santé humaine (voir chapitre « Effets sanitaires ») ; il a aussi des effets néfastes sur la végétation. Ces effets peuvent être particulièrement significatifs pour certaines récoltes et peuvent donc se traduire par des impacts économiques liés à des diminutions des rendements agricoles. Ils peuvent aussi affecter les forêts comme c’est le cas en Californie. Les premiers symptômes de dépôt d’ozone néfaste apparaissent sur la surface supérieure des feuilles ; ils sont plus importants sur les feuilles les plus exposées à la lumière. Les effets varient selon les essences de feuillus, de conifères et de cultures : les principaux symptômes sont une décoloration des feuilles exposées à la lumière (chlorose, « photobleaching » ), des petites tâches sur la surface des feuilles (« stippling », « mottling ») ou une coloration brune sur les parties supérieures des feuilles (« bronzing »). Le mécanisme qui mène à ces effets peut être résumé de la façon suivante. L’ozone est absorbé par les stomates de la plante, puis réagit avec des molécules organiques, telles que l’isoprène et l’éthylène, présentes dans le fluide végétal extra-cellulaire. Des composés organiques oxydants sont formés, qui réagissent alors avec les protéines des membranes cellulaires de la plante. Cette détérioration des membranes mène aux effets visibles d’une exposition de végétaux à des concentrations d’ozone élevées. Par ailleurs, d’autres effets secondaires peuvent se produire, tels qu’une réduction de la fixation du CO2 (soit par perturbation de la fonction enzymatique, soit par dommage des stomates). La perturbation de la photosynthèse du végétal mène à un vieillissement précoce des feuilles et à une diminution des rapports racines/jeunes pousses et graines/biomasse. Par conséquent, une diminution du rendement en graines ou en feuillage sain s’ensuit. L’exposition de la végétation à l’ozone est quantifiée au moyen de la fonction « AOT40 » (« Accumulated ozone exposure over a threshold of 40 ppb ») qui correspond à l’exposition cumulée du végétal aux concentrations d’ozone supérieure à 40 ppb pendant les heures de la journée sur une période de 3 mois (mai à juilllet) pour les cultures et de 6 mois (avril à septembre) pour les arbres. Des valeurs seuil d’AOT40 de 3 000 ppb.h sur trois mois pour les cultures et de 10 000 ppb.h sur six mois pour les arbres ont été proposées par l’Union Européenne. 3.2 Les pluies acides L’acidité de l’eau est représentée sur une échelle logarithmique par le pH. Le pH est la valeur négative du logarithme à base 10 de l’activité du proton H+ . pH = - log(γH+ [H+ ]) Pour une solution qui n’est pas très concentrée en espèces chimiques autres que l’eau, on peut faire l’approximation d’une solution idéale et le coefficient d’activité γH+ est alors égal à 1. Le pH est alors relié directement à la concentration des ions hydrogène. pH = - log([H+ ]) L’eau pure a un pH neutre de 7, puisque les ions H+ et OH- sont présents en concentrations identiques. H2O <=> H+ + OH- KH2O = [H+ ] [OH- ] = 10-14 M2 où M est l’unité mole par litre. Donc, [H+ ] = [OH- ] = 10-7 M pH = - log(10-7) = 7 Cependant, l’eau liquide dans l’atmosphère n’a pas un pH neutre de 7, même en l’absence de pollution. En effet, le dioxyde de carbone (CO2) présent naturellement dans l’atmosphère est un acide faible en solution aqueuse (c'est-à-dire que l’acide H2CO3, formé à partir de CO2 et H2O, ne se dissocie pas complètement dans l’eau mais ne donne qu’une dissociation partielle menant à H+ et des ions bicarbonate HCO3 - et carbonate CO3 = ). Pour une concentration atmosphérique de CO2 de 380 ppm (parties par million), c'est-à-dire 380 x 10-6 atm, le calcul du pH d’une goutte de nuage ou de pluie avec une telle concentration de CO2 donne un pH de 5,6. Une pluie acide est donc une pluie dont le pH est inférieur à 5,6. Les espèces chimiques qui mènent à des pluies acides sont des acides forts (c'est-à-dire qu’ils se dissocient complètement dans l’eau en ions H+ et anions). Dans l’atmosphère, les principaux acides forts sont l’acide sulfurique (H2SO4), l’acide nitrique (HNO3) et l’acide chlorhydrique (HCl). La découverte des pluies acides remonte au début de l’ère industrielle. Si les références originales données dans la littérature anglo-saxonne sont principalement les publications de Smith (R.A. Smith, « On the air and rain of Manchester », Memoirs of the Literary and Philosophical Society of Manchester, Series 2, 10, 207-217, 1852 ; Air and rain : the beginnings of a chemical climatology, Longmans Green, Londres, Royaume Uni, 1872), la première publication scientifique sur le sujet est due à un pharmacien français (M. Ducros, « Observation d’une pluie acide », J. Pharmacie Chimie Série 3, 7, 273-277, 1845) qui suggérait une acidité de la pluie due à l’acide nitrique (résultant par exemple de la production d’oxydes d’azote lors d’orages). Une ré-analyse des données de Smith sur les pluies dans la région de Manchester suggère que l’acidité y était principalement due à HCl. Il est possible que la combustion du charbon dans cette région ait mené à de fortes concentrations en HCl dans l’atmosphère (le chlore est un des composés présents dans le charbon et il est émis principalement sous forme d’HCl lors de la combustion du charbon). Il convient de noter que la pollution intitulée « pluies acides » recouvrent en réalité des dépôts secs (par exemple les particules de sulfate et l’acide nitrique gazeux se déposent sur les surfaces) et des dépôts humides. Par ailleurs, les dépôts humides comprennent non seulement les pluies mais aussi les chutes de neige et de grêle et les dépôts humides occultes.Les oxydes d’azote (monoxyde d’azote, NO, et dioxyde d’azote, NO2) sont émis lors de tous les processus de combustion car l’azote (N2) et l’oxygène (O2) de l’air se recombinent aux hautes températures lors de la combustion. (On parle de NOx pour l’ensemble de NO et NO2.) Les UV agissent sur la molécule du dioxyde d'azote et aggravent sont acidification. L'avancement des activités humaines va aggraver ce polluant dans atmosphère étant soumis a des UV plus fort a certaines heure de la journée. La pollution des pluies acides est une pollution qui couvre de longues distances (plusieurs centaines de kilomètres). Il faut aussi noter qu’il existe des sources naturelles de SO2 et de NOx. Les éruptions volcaniques mènent à des émissions significatives de SO2. Les océans émettent du diméthyle de soufre qui s’oxyde lentement en SO2. Les sols émettent des oxydes d’azote (NOx et aussi du protoxyde d’azote, N2O, un gaz à effet de serre). La foudre produit des NOx dans les hautes couches de l’atmosphère. Les tableaux 1 et 2 résument les principales catégories de sources de SO2 et NOx. Un autre effet des pluies acides est la détérioration du bâti. Certaines pierres sont de type calcaire (y compris le tuffeau et certains marbres). Ce calcaire qui est du carbonate de calcium réagit par exemple avec l’acide sulfurique pour donner du sulfate de calcium (gypse). Cette réaction mène à une modification de l’intégrité de la pierre (qui n’est donc plus homogène dans sa composition minérale) et un effritement de la pierre. Les polluants azotés La végétation a besoin d’azote pour sa croissance. De façon naturelle, les végétaux « fixent » l’azote de l’atmosphère et des sols. L’agriculture utilise des engrais azotés (par exemple nitrate d’ammonium) pour augmenter les rendements de certaines cultures. Une augmentation trop importante des composés azotés dans le milieu aquatique mène aussi à une augmentation de la végétation aquatique. Cette augmentation de la végétation en surface mène à une diminution de la quantité de lumière qui peut atteindre les couches basses de la colonne d’eau. Cette diminution de rayonnement a un effet néfaste sur la photosynthèse des plantes qui utilise le rayonnement pour produire de l’oxygène à partir de dioxyde de carbone. La baisse de production d’oxygène mène à des conditions anoxiques (c'est-à-dire sans oxygène). Une baisse des concentrations d’organismes vivants (phytoplancton, zooplancton) s’ensuit, faute de suffisamment d’oxygène dans les basses couches du lac ou de la rivière. Ce phénomène lié à une augmentation des apports azotés s’appelle l’eutrophisation. Ses conséquences sont une augmentation de la végétation en surface et une diminution de la vie aquatique dans les zones plus profondes. 8 Les principaux dépôts atmosphériques azotés sont l’acide nitrique (qui est aussi un contributeur des pluies acides) et l’ammoniac. (Les oxydes d’azotes, NOx, sont assez peu solubles dans l’eau et ont par conséquent des contributions aux dépôts secs et humides qui sont faibles ; les nitrates organiques contribuent de façon similaire aux NOx et donc significativement moins que l’acide nitrique et l’ammoniac.) Les sources anthropiques des précurseurs (NOx) de l’acide nitrique ont été mentionnées dans le chapitre précédent sur les pluies acides. Les sources principales de l’ammoniac atmosphérique sont les activités agricoles : d’une part l’utilisation d’engrais pour les cultures et d’autre part l’élevage. Les tableaux 2 et 3 résument les principales catégories de sources pour les oxydes d’azote et l’ammoniac atmosphériques.








/http%3A%2F%2Fstorage.canalblog.com%2F95%2F24%2F1390704%2F133190135_o.jpg)
/http%3A%2F%2Fstorage.canalblog.com%2F11%2F65%2F1390704%2F110031153_o.jpg)
/http%3A%2F%2Fstorage.canalblog.com%2F17%2F81%2F1390704%2F124235444_o.jpg)
/http%3A%2F%2Fstorage.canalblog.com%2F20%2F11%2F1390704%2F124433363_o.jpg)